研究開発の背景
<細胞の足場依存性と細胞外マトリックス>
生体から分離した細胞を培養するとき、培養皿に接着しない細胞は増殖することができません。それどころかアポトーシスとよばれる自発的な死のプログラムを作動させて、細胞は自ら死んでしまいます。この現象は細胞増殖の足場依存性と呼ばれていて、動物の身体をつくるすべての細胞で観察される基本的な属性です。
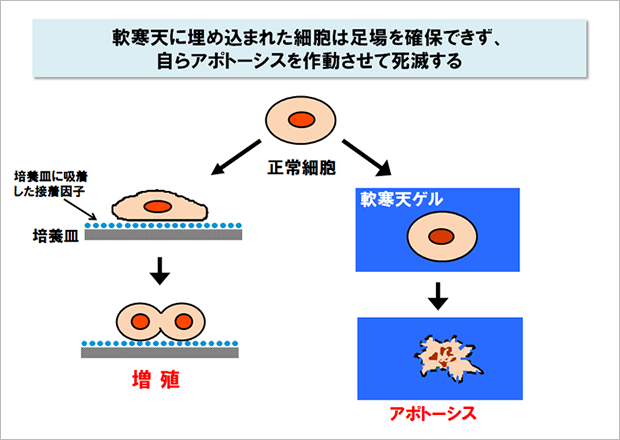
なぜ細胞は足場が確保できないと増殖できず、自ら死んでしまうのでしょう?その謎を解く鍵は細胞外マトリックスにありました。今から30年ほど前、インテグリンとよばれる一群の受容体が細胞表面から発見され、このインテグリンが細胞外マトリックスと結合すると増殖を促し、アポトーシスを阻止する信号を細胞内に伝えることがわかったのです。
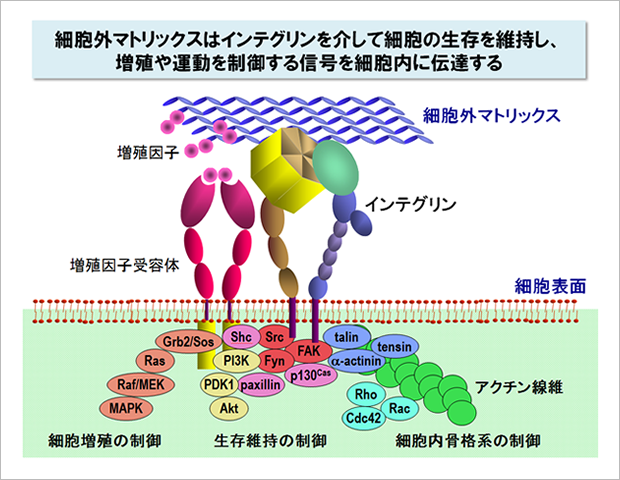
従来、細胞の増殖は増殖因子が細胞表面の受容体と結合し、増殖を促す信号を細胞内に伝えることにより制御されていると考えられてきました。しかし、細胞が増殖するためには、増殖因子からの信号だけでは不十分で、細胞外マトリックスからインテグリンを介して伝わる信号が同時に入力される必要があったのです。細胞外マトリックスは単なる物理的な足場ではなく、細胞の周囲に固相化された増殖因子としての役割を担っています。
<基底膜と間質>
細胞外マトリックスには、細胞をぐるりと取り囲む“間質”と、カーペットのように細胞の底面に貼りつく“基底膜”の2種類があります。
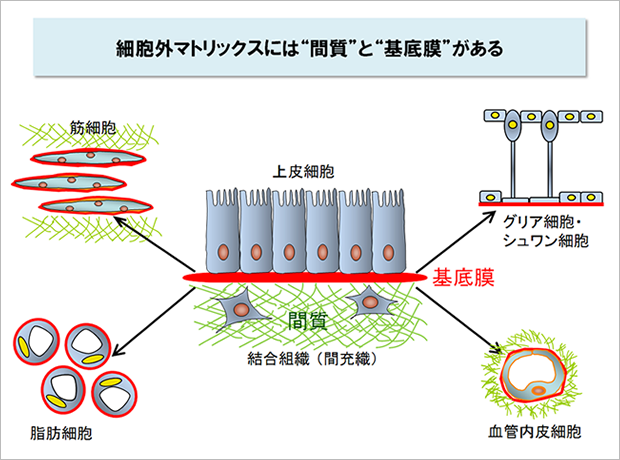
従来、細胞外マトリックスの研究は間質、特にその主要な構成分子であるコラーゲンやヒアルロン酸などを主な対象として進められてきました。しかし、私たちの身体をよくみてみると、多くの細胞が足場としているのは間質ではなく、基底膜であることがわかります。心臓、腎臓、膵臓、皮膚、眼、血管など、様々な臓器の機能を担っている細胞は基底膜を足場としています。多くの細胞はインテグリンを介して基底膜に接着することにより、アポトーシスを回避し、秩序正しく増殖するための信号を受け取っているのです。
<基底膜を構築するタンパク質>
これまでの研究から基底膜には約50種のタンパク質が含まれていることがわかっています。その中にはどの細胞の基底膜でもかならず含まれている構成的成分と、特定の細胞の基底膜だけに含まれている細胞特異的成分があり、基底膜の分子組成は細胞ごとに異なっています※。
※基底膜がどのようなタンパク質でできているかを免疫組織化学的に調べた結果を収録した画像データベース[マウス基底膜ボディマップ(Mouse Basement Membrane Bodymap)]がインターネット上で公開されています。
代表的な基底膜タンパク質としてはラミニン、ニドゲン、IV型コラーゲン、パールカンが知られています。これらはどの細胞の基底膜にも含まれている構成的成分で、すべての多細胞動物がそれらの遺伝子をもっています。なかでも細胞の足場として中心的役割を果たすのはラミニンです。細胞表面にはラミニンと選択的に結合する数種類のインテグリンが存在して、これらが基底膜のラミニンと結合するとアポトーシスを回避し、増殖を促す信号が細胞内に伝わります。
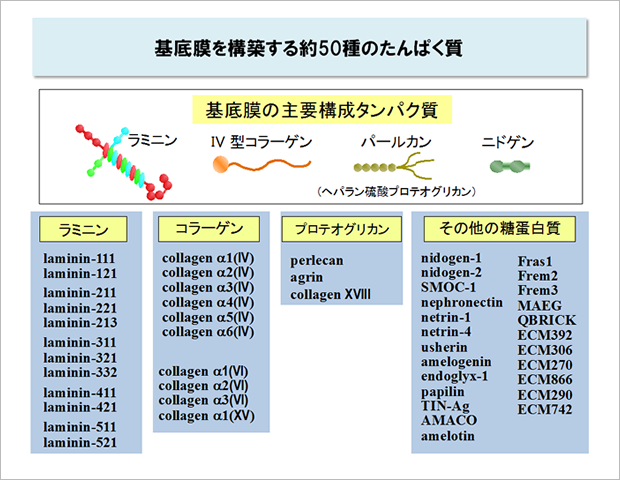
<ラミニン>
ラミニンはα鎖、β鎖、γ鎖が1:1:1で会合したタンパク質です。α鎖の分子量は約40万、β鎖とγ鎖はそれぞれ約20万で、3本鎖が会合したラミニンの分子量は約80万です。ヒトでは5種類のα鎖(α1、α2、α3、α4、α5)、3種類のβ鎖(β1、β2、β3)とγ鎖(γ1、γ2、γ3)が存在し、それらの組み合わせが異なる少なくとも12種類のラミニンが同定されています。
基底膜がどのタイプのラミニンでできているかは、細胞ごとに異なっています。特にα鎖の組成は細胞ごとに特徴があります。心筋や骨格筋の細胞はα2鎖のラミニンを足場として使いますが、皮膚や角膜ではα3鎖のラミニンを主に使っています。血管の細胞はα4鎖のラミニンを、神経や網膜の細胞や初期胚の細胞はα5鎖のラミニンを足場としています。細胞ごとに足場として最適なラミニンは違っているのです。※
※基底膜がどのラミニンでできているかは、基底膜タンパク質の局在情報を収録した画像データベース[マウス基底膜ボディマップ(Mouse Basement Membrane Bodymap)]をご覧ください。
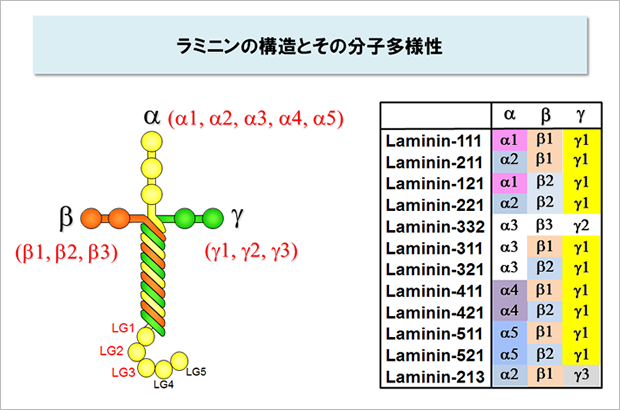
電子顕微鏡で観察すると、ラミニンは十字架の形をしています。インテグリンは十字架の長腕の末端部に結合します。このインテグリン結合部位はα鎖、β鎖、γ鎖のC末端領域からできていて、α鎖、β鎖、γ鎖のどれか一つが欠けても活性は失われてしまいます。特にα鎖のC末端領域にある3個の球状ドメイン(LG1, LG2, LG3)とγ鎖のC末端側の8アミノ酸残基がインテグリン結合活性に不可欠であることが知られています。1,2,3
1 Ido H, et al. (2004) J Biol Chem 279:10946-10954.
2 Ido H, et al. (2007) J Biol Chem 282:11144-11154.
3 Taniguchi Y, et al. (2009) J Biol Chem 284:7820-7831.
<ラミニン-511>
α5鎖がβ1鎖とγ1鎖と会合したラミニンをラミニン-511と呼びます。これは各ラミニンをサブユニット鎖の組成をあらわす3桁の数字であらわすことになっているからです。ラミニン-111はα1β1γ1という組成をもつラミニンを指し、ラミニン-332はα3β3γ2という組成のラミニンを指します。α5鎖は5種類のα鎖の中で最後に見つかったα鎖ですが、分子系統学的にはα鎖のプロトタイプと考えられていて、実際、初期胚で最初に出現するのはα5鎖です。
ラミニン-511は多数のラミニンの中でもインテグリンに対して非常に強く結合することが知られています。ラミニンと結合するインテグリンにはα3β1、α6β1、α6β4、α7β1という4種類がありますが、ラミニン-511はインテグリンα6β1に対して高い親和性を示します。
ES細胞やiPS細胞のような多能性幹細胞はインテグリンα6β1を高発現しており、ラミニン-511を培養基質としてつかうとヒト多能性幹細胞の接着性が向上し、効率よく培養できることが知られています。4,5
4 Miyazaki T, et al. (2008) Biochem Biophys Res Commun 375:27-32.
5 Rodin S, et al. (2010) Nat Biotech 28:611-615.
<ラミニン-511 E8フラグメント>
ラミニン-511は幹細胞の培養基質として非常に有用ですが、分子量が80万と非常に大きい上に、α、β、γの3本鎖からできているため、組換えタンパク質を大量に調製することが容易ではありません。
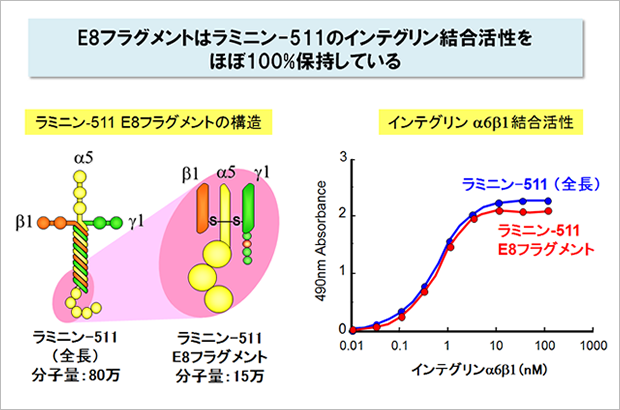
関口教授らは、ラミニン-511のインテグリン結合部位を含む組換えフラグメント(分子量15万)を開発し、このフラグメントがラミニン-511のインテグリン結合活性をほぼ100%保持していることを見いだしました。
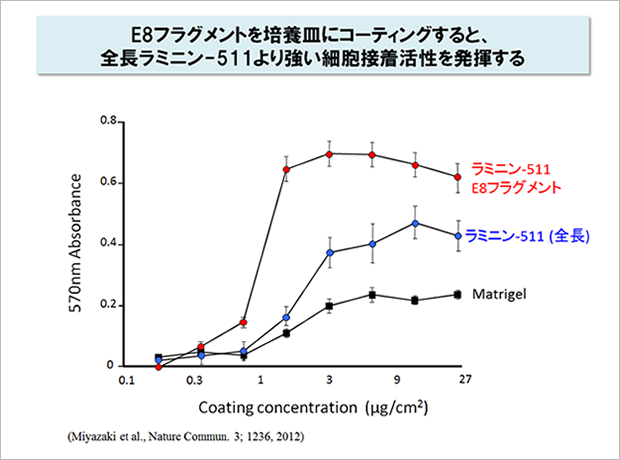
ラミニン-511 E8と呼ばれるこのフラグメントを培養基質として使うと、全長のラミニン-511よりも多能性幹細胞の接着がよく、培養効率も向上することがわかりました。現在、ラミニン-511 E8フラグメントはiMatrix-511として製品化され、ヒト多能性幹細胞用の培養基質として多くの研究者に使われています。7-10
7 Miyazaki T, et al. (2012) Nature commun 3:1236.
8 Nakagawa M, et al. (2014) Scientific reports 4:3594.
9 Doi D, et al. (2014) Stem Cell Reports 2:337-350.
10 Hayashi R, et al. (2016) Nature 531:376-380.